La loi Jardé, votée en mars 2012, a pour but de donner un cadre législatif et réglementaire aux essais cliniques qui impliquent des personnes. Universal Medica résume les grands points du décret n° 2017-884 du 9 mai 2017 qui en modifie certaines dispositions.
Création de 3 nouvelles catégories
Avec la loi Jardé, les « Recherches biomédicales (RBM) » changent de nom pour désormais se nommer « Recherches Impliquant la Personne Humaine (RIPH) ». Les RIPH sont divisées en 3 catégories selon le niveau d’intervention sur la personne.
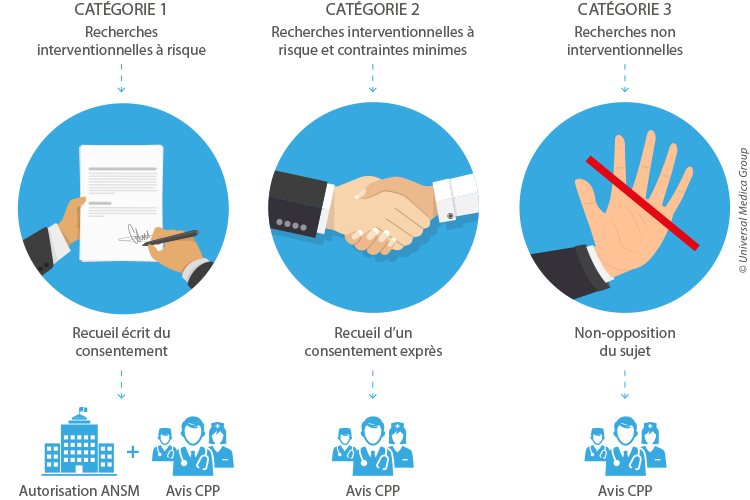
CATÉGORIE 1 : les recherches interventionnelles qui comportent une intervention sur la personne non justifiée par sa prise en charge habituelle.
CATÉGORIE 2 : les recherches interventionnelles à risques minimes qui ne comportent que des risques et des contraintes minimes (liste fixée par arrêté du ministre de la santé et après avis du directeur de l’ANSM). Cette catégorie est anciennement les « recherches en soin courant ».
CATÉGORIE 3 : les recherches non interventionnelles dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans procédure supplémentaire ou inhabituelle de diagnostic, de traitement ou de surveillance.
La recherche non interventionnelle rétrospective (portant sur les dossiers médicaux, et non sur les personnes) n’entre pas dans la loi Jardé.
Démarches réglementaires
1/. Comité de Protection des Personnes (CPP)
Toutes les recherches sont soumises à l’avis d’un CPP à désignation aléatoire, par tirage au sort. Le CPP devient la seule instance éthique pour toutes les RIPH avec une demande d’avis favorable obligatoire pour les 3 catégories de recherches.
2/. Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM)
Toutes les RIPH sont diffusées dans un répertoire public : n° ID-RCB (demande auprès de l’ANSM). La demande d’autorisation de l’ANSM est obligatoire uniquement pour les recherches de catégorie 1. Pour les recherches de catégories 2 et 3, il faut envoyer à l’ASNM une copie de l’avis favorable du CPP et le résumé de la recherche.
3/. Commission Nationale de l’Informatique et des Libertés (CNIL)
Avec la mise en place de méthodologies de référence (MR), les procédures de déclaration à la CNIL sont simplifiées à la réalisation d’un engagement de conformité avec :
- • MR-001 pour les recherches de catégorie 1 et 2
- • MR-003 pour les recherches de catégorie 3
4/. Assurance
La souscription d’une assurance est obligatoire pour les recherches de catégorie 1 et 2 mais pas pour les recherches de catégorie 3.
Modalités de consentement
La loi Jardé adopte une approche fondée sur le risque : plus le risque encouru pour le sujet est important, plus l’encadrement juridique du consentement sera lourd. Les modalités de consentement varient selon le degré d’intervention de l’étude :
CATÉGORIE 1 : le consentement libre et éclairé et recueilli par écrit.
CATÉGORIE 2 : le consentement libre et éclairé, et exprès (écrit ou oral). Le consentement n’est pas nécessairement recueilli par écrit dès lors qu’il est exprès.
CATÉGORIE 3 : la non-opposition de la personne suffit.
Vigilance renforcée
Il n’y a pas de changement dans les définitions EI/EIG (Evènement Indésirable/Grave), ni dans les critères de gravité. Cependant la définition d’un fait nouveau de sécurité est modifiée. Pour les essais portant sur la 1ère administration/utilisation d’un produit de santé, renforcement de la protection des volontaires sains : tout effet indésirable grave est constitutif d’un fait nouveau.
Pour toutes les recherches, le promoteur déclare un fait nouveau susceptible de porter atteinte à la sécurité des personnes, sans délai à l’ANSM et au CPP. Le promoteur et l’investigateur prennent les mesures de sécurité urgentes appropriées en cas de EIGI (Effet Indésirable Grave et Inattendu) ou de fait nouveau susceptibles de porter atteinte à la sécurité des personnes qui s’y prêtent.