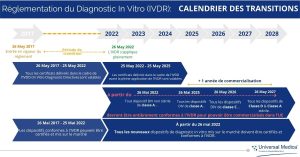
À l’approche de la fin de de la période de transition de la réglementation DMDIV qui sera effective le 26 mai 2022, tous les nouveaux dispositifs de diagnostic in vitro et les dispositifs médicaux de diagnostic in vitro de Classe A non stériles devront être conformes à la règlementation DMDIV pour être commercialisés au sein de l’Union Européenne. Tous les fabricants de dispositifs médicaux de diagnostic in vitro certifiés CE seront affectés par cette nouvelle règlementation. Tout dispositif médical ne répondant pas à ces nouvelles exigences ne pourra plus être commercialisé en Europe.
En raison du retard causé par le Covid-19, la Commission Européenne a décidé d’étendreles délais de transition pour les produits déjà sur le marché européen avant le 26 mai 2022 afin de garantir une continuité dans l’approvisionnement de produits essentiels.
Délais de transition (voir infographies)
La nouvelle réglementation relative aux dispositifs médicaux de diagnostic in vitro a pour objectif de garantir un haut niveau de sécurité des patients dans tous les États membres de l’Union Européenne. La réglementation DMDIV a les mêmes fondamentaux que la précédente directive. Des améliorations significatives ont été apportées afin de moderniser le système actuel.
Comparée à l’ancienne directive, la règlementation DMDIV est beaucoup plus rigoureuse, notamment en ce qui concerne les catégories de risque et la surveillance par les organismes notifiés. Cela signifie que tous les dispositifs de diagnostic in vitro qui ne nécessitent actuellement que l’auto-certification devront désormais inclure un organisme notifié dans le cadre du processus d’évaluation de la conformité.
Selon cette nouvelle régulation, tous les dispositifs de diagnostic in vitro sont répartis dans des classes A, B, C et D en fonction de leur utilisation prévue et des risques qu’ils comportent.
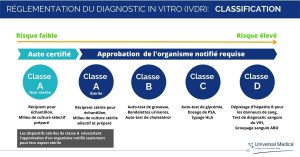
La période de transition de réglementation DMDIV arrivant à son terme, les fabricants de dispositifs de diagnostic in vitro doivent se tenir au fait des tous les éventuels changements et respecter les normes.
N’hésitez pas à contacter nos experts dès aujourd’hui pour savoir comment Universal Medica peut vous guider à comprendre les modalités de mise en œuvre de la règlementation du diagnostic in-vitro.
Sources:




