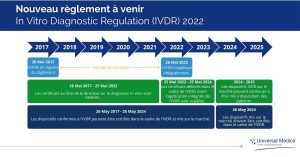
Après une période de transition de cinq ans, l’IVDD (In Vitro Diagnostic Directive) sera remplacée par l’IVDR (In Vitro Diagnostic Regulation) le 26 mai 2022 et s’appliquera à tous les dispositifs de diagnostic in vitro commercialisés dans les États membres de l’UE.
L’IVDR comporte les mêmes exigences de base que l’IVDD, mais avec certaines améliorations majeures pour moderniser le système actuel. Par rapport à l’IVDD, l’IVDR est plus rigoureux, notamment en ce qui concerne les classes de risque et la surveillance par les organismes notifiés.
Le nouveau règlement sur les dispositifs de diagnostic in vitro vise à garantir un niveau élevé et cohérent de sécurité des patients dans tous les États membres de l’UE.
Alors que la période de transition de l’IVDR touche à sa fin, il est important d’être en conformité avec l’IVDR. Contactez notre expert aujourd’hui pour en savoir plus sur l’IVDR et sur la façon dont vous pouvez le mettre en œuvre dans votre entreprise.
Dernière mise à jour – L’Union européenne a récemment proposé de retarder la date limite de la période de transition vers l’IVDR pour certaines activités en raison du retard pris par le COVID. La proposition va maintenant être soumise au Parlement européen et au Conseil pour approbation.




